Eletroquímica e o fenômeno de transferência de
elétrons da energia química para a elétrica ou vice-versa.
Pilha
de Deniell é um experimento onde contém um eletrodo negativo (ânodo) e um
positivo (cátodo), o ânodo é uma placa de zinco mergulhada em solução de
sulfato de zinco e o cátodo é uma é uma placa de cobre mergulhada em solução de
cobre que produzem energia que é transferida pela ponte salina.
Objetivo:
O experimento teve por objetivo verificar se as reações ocorridas se tratavam
de oxirredução.
01: Metodologia: Primeira
parte: Reação entre nitrato de prata e cobre metálico.
· Materiais:
nitrato de prata 0,1 M; fios de cobre metálico
· Solução
de nitrato de prata (AgNO3) mais cobre metálico
· Verificar
se há condução de eletricidade (voltagem diferente de zero)
· Verificar
o tempo de reação
02: Segunda parte: Reação entre ácido
clorídrico e metais.
· Materiais:
ácido clorídrico 1 M; ferro metálico em aparas; placa de zinco metálico
· Ferro
metálico em aparas mais ácido clorídrico
· Zinco
metálico em placa mais ácido clorídrico
· Verificar
se há condução de eletricidade (voltagem diferente de zero)
03: Terceira parte: Pilha de Daniel
A
pilha de Daniell era constituída por duas semi células ou semi células
eletroquímicas. A primeira era formada por uma placa de zinco mergulhada em uma
solução de sulfato de zinco (ZnSO4) em um béquer, e a outra era formada por uma
placa de cobre mergulhada em uma solução de sulfato de cobre II (CuSO4) em
outro béquer. Essas duas placas eram interligadas por um fio de cobre condutor.
Além disso, as duas soluções estavam conectadas por um tubo que continha uma
solução eletrolítica, isto é, uma ponte salina.
Observe
o esquema da montagem da pilha de Daniell na foto a seguir:
Esquema de pilha de zinco-cobre também chamada de pilha de Daniell
O
funcionamento dessa pilha ocorria da seguinte forma: Como mostra a fila de
reatividade dos metais mostrada no texto Reações de simples troca, o zinco é
mais reativo que o cobre, por isso, tem maior tendência de oxidar-se, isto é,
de perder elétrons. Assim, a placa de zinco constitui o eletrodo negativo,
chamado de ânodo, onde ocorre a seguinte reação de oxidação:
Semi-reação
no ânodo: Zn(s) ↔ Zn2+(aq) + 2 e-
Os
elétrons perdidos pelo zinco são transferidos através do fio de cobre para a
placa de cobre e depois para a solução de sulfato de cobre II. Os íons cobrem
(Cu2+) presentes na solução recebem esses elétrons e sofrem redução. Isso nos
mostra que a placa de cobre constitui o eletrodo positivo, chamado de cátodo,
onde ocorre a seguinte reação de redução:
Semi-reação
no cátodo: Cu2+(aq) + 2 e- ↔ Cu(s)
Somando
essas duas semi-reações, chegamos à reação global da pilha de Daniell:
Semi-reação
no ânodo: Zn(s) ↔ Zn2+(aq) + 2 e-
Semi-reação
no cátodo: Cu2+(aq) + 2 e- ↔ Cu(s)
Reação
Global: Zn(s) + Cu2+(aq) ↔ Zn2+(aq) + Cu(s)
Inicialmente
a solução de CuSO4 era azul por causa da presença dos cátions Cu2+. Mas com a
ocorrência da reação de redução desses cátions, sua concentração diminuiu em
solução e, consequentemente, a solução ficou incolor. Além disso, na reação de
redução do cátion cobre, é formado cobre metálico Cu(s), que se deposita na
placa de cobre. É por isso que depois do funcionamento da pilha de Daniell
pode-se observar que a massa da placa de cobre está maior.
Por
outro lado, a placa de zinco é corroída, pois o zinco metálico (Zn(s)) é
transformado em íons zinco (Zn2+) que são transferidos para a solução de ZnSO4.
Esses fenômenos podem ser observados na imagem a seguir:
Pilha
de Daniell depois de seu funcionamento
A
convenção mundial de representação das pilhas é feita com base na seguinte
ordem:
Convenção
mundial de representação das pilhas
Assim,
a representação da pilha de Daniell é dada por:
04: Resultados e Debate:
Reação
entre nitrato de prata e cobre metálico
Em
um béquer de 50 mL foram adicionados fios de cobre metálico.
Na
sequência foi adicionada a solução de nitrato de prata e disparado o
cronômetro. Após aproximadamente 10 minutos, a solução, inicialmente incolor,
passou a apresentar coloração azulada, sobre os fios de cobres formou-se camada
acinzentada e observou-se ainda a precipitação de prata em cristais brancos
sobre a camada cinza dos fios.
Para
verificar se houve condução de corrente elétrica, foi medida a voltagem da
solução com auxílio do multímetro. Observou-se tensão não nula, logo há troca
de elétrons, tratando-se assim de uma reação de oxirredução.
Analisando
a reação ocorrida, como a prata encontrava-se inicialmente em íons aquoso Ag+ e
ao final da reação encontrava-se precipitada, ou seja, prata metálica Ag0, esta
recebeu elétrons, portanto reduziu. Desse modo, o cobre doou elétrons, oxidando
de Cu0 a Cu2+, sendo estes íons responsáveis pelo aspecto azul da solução.
Assim, tem-se:
Semi-reação
no cátodo: Cu0(s) → Cu2+(aq) + 2e-
Semi-reação
no ânodo: 2 Ag+(aq) + 2e- → 2 Ag0(s)
Reação
Global: Cu0(s) + 2 Ag+(aq) → Cu2+(aq) + 2 Ag0(s)
Em
outro béquer foi repetido o experimento com menor quantidade de cobre e
observou-se precipitação.
1. Reação entre ácido
clorídrico e ferro metálico
2. Pilha de Daniel
Trata-se de uma reação de óxido-redução em que o zinco sofre
oxidação e os íons cobre sofrem redução.
11 O zinco sofreu
oxidação: perdeu elétrons e seu número de oxidação aumentou.
1
22 O íon Cu2+ sofreu
redução: recebeu elétrons e seu número de oxidação.
Em uma óxido-redução, a espécie que se oxida — o zinco, no caso
— transfere elétrons para a que se reduz — os íons cobrem (II), no caso. E se
conseguirmos fazer com que essa transferência ocorra por meio de um fio
metálico?
Seria estabelecida uma corrente elétrica.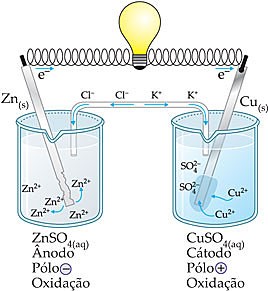




Comentários
Postar um comentário